Aβイメージング
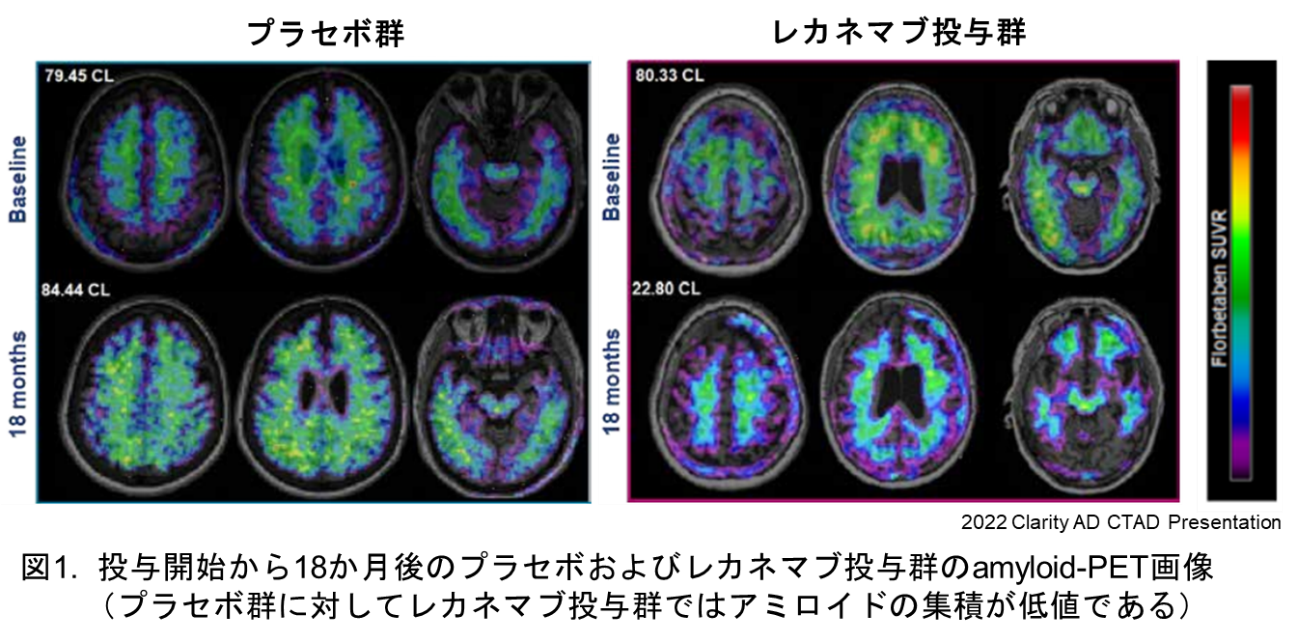
去る2023年7月6日、米食品医薬品局(FDA)は日本の製薬大手エーザイと米医薬品大手バイオジェンが共同開発したアルツハイマー病治療薬「レカネマブ」を正式に承認したと発表しました。これにより、脳内のAβ量を測定するアミロイドPETを取り巻く環境は大きく変わると考えられています(図1)。日本でも独立行政法人医薬品医療機器総合機構(PMDA)により正式に承認された場合、本薬剤による治療を受けるにあたり、脊髄穿刺による脳脊髄液中Aβの測定若しくはアミロイドPETによる診断が必須となる可能性が高いと考えられます。前者は侵襲性が高い為、高額ではあるものの後者のPETへのニーズが高まることが予想されます。このような社会情勢を鑑み、当センターでも10年ほど前に凍結したアミロイドPET検査について、昨今の医療情勢に則した形での運用で、検査実施に向けた取り組みを開始したいと考えております。
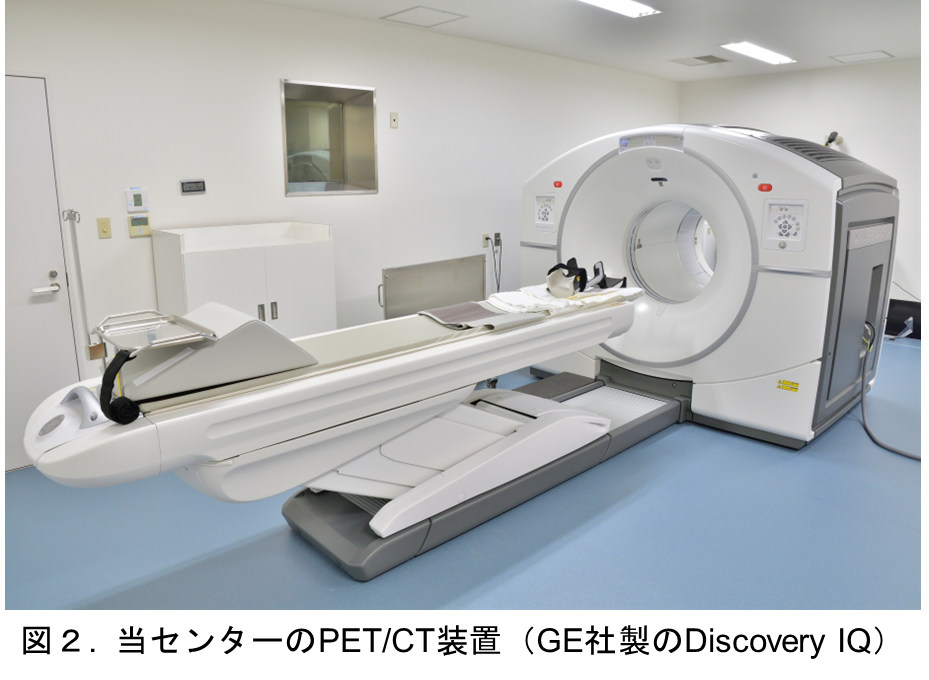
具体的な取り組みとしまして、先ず、PETカメラに関して日本核医学会の撮像認証に対応します。これは、当センターのGE社製PET/CT装置(図2)がアミロイドPET検査用機器として、学会の求める精度基準を満たしているかを調べるという内容です。これにはファントムと呼ばれる脳を模した筒状の校正用模型にPET薬剤を封入し、実測により得られた画像を精査します。特段の問題がなければ、承認されると考えております。
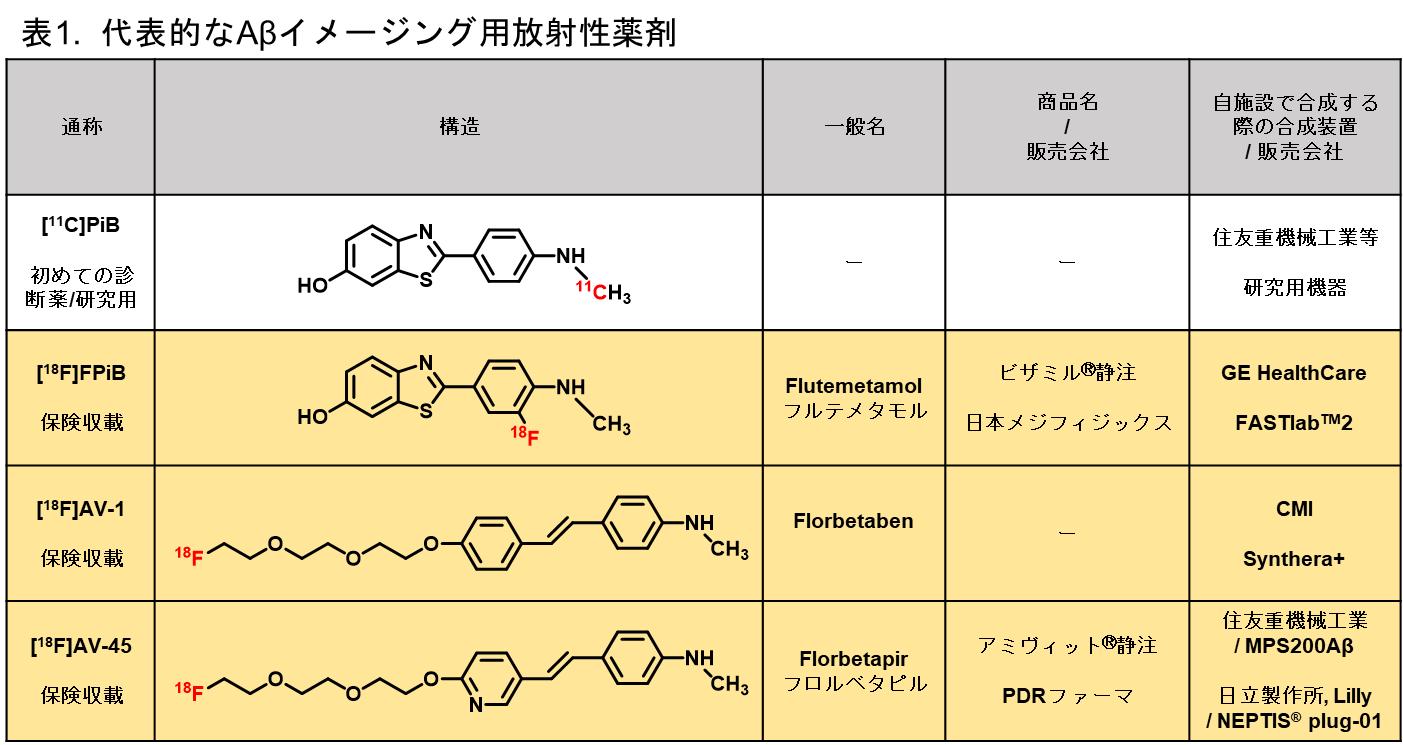
次いで、薬剤の選択です。アミロイドイメージング薬剤の先駆けであり、基準となる[11C]PiBが開発されて以降、10年ほど前までは、アミロイドPET用薬剤が乱立し、様々な施設で薬剤の評価が行われていました。結果、多施設共同研究による集積画像等の比較により薬剤の絞り込みが行われ、現在では、[18F]florbetapir、[18F]flutemetamol、[18F]florbetabenの3種が薬事承認されるに至りました(表1)。いずれも医療機器(放射性薬剤合成装置)および、製薬会社からの販売網が整備されておりますが、薬価基準未収載の為、現在のところ保険診療は認められていません。今後、アルツハイマー型認知症(AD)治療薬の承認により、上記3種の薬剤に薬価が付くことが予想されます。